导语
I 型神经纤维瘤病(NF1)是由 NF1 基因突变引起的常染色体显性遗传性疾病,患病率约为 1/4,000~1/2,000,患者多幼年起病,临床表现以咖啡牛奶斑和多发性神经纤维瘤为特征[1]。其中约 50% 的患者会出现丛状纤维神经瘤(PN)[2],NF1-PN 在儿童时期增长迅速,并有转变为恶性周围神经鞘肿瘤(MPNSTs)的风险[3]。手术治疗是目前 NF1-PN 的主要治疗手段,但存在一定局限性,部分神经纤维瘤具有广泛累及正常组织、术中易出血、累及重要神经等特点,增加了术中出血、术后神经功能障碍等并发症的发生率,手术操作难度大,且易出现术后复发[1][4]。下面分享一例 NF1-PN 两次术后复发的儿童病例,其个体化治疗策略值得借鉴。
病例介绍
患儿男性,5 岁,主因「发现左侧颈部包块 6 月余」于 2021 年 5 月入院。
现病史:6 月前,左侧颈部肿块,无红肿,无自觉疼痛,平卧位或休息后可消失。未予治疗,病情无明显好转,肿块逐渐增大。2021 年 5 月,为求进一步治疗入院。
入院查体:左颈部可及多发肿块,较大者直径约 30 mm,质硬,无压痛,表面皮肤无红肿,无破溃。全身多发牛奶咖啡斑,最大者左上肢内侧直径 5 cm。
辅助检查:颈部 MRI 显示左颈部-上纵隔见异常信号占位,上至左侧咽旁间隙,下达左上纵隔,呈蠕虫状改变,范围约 24.5 * 62.0 * 162.4 mm
诊断:
NF1 的诊断标准(满足两条及以上即可确诊)[5]
6 个或以上咖啡牛奶斑,在青春期前直径(最长径)> 5 mm 或在青春期后直径 > 15 mm;
双侧腋窝或腹股沟区雀斑;
2 个或以上任何类型的神经纤维瘤或 1 个丛状神经纤维瘤;
2 个或以上 Lisch 结节(虹膜错构瘤),2 个或以上的脉络膜异常;
视路胶质瘤;
特征性骨变,如蝶谷翼发育不良,胫骨前外侧弯曲(胫骨发育不良)或长骨假关节;
NF1 基因杂合变异;
父母一方通过以上标准被诊断为 NF1
因患儿符合以上诊断标准中的两条,可确诊 NF1,由于颈部 MRI 显示左颈部-上纵隔蠕虫状异常信号占位,判断为 PN。术后病理进一步明确 PN 诊断,并排除了肿瘤恶变。综上所述,诊断为 I 型神经纤维瘤病相关丛状神经纤维瘤(NF1-PN)。
治疗经过:
2021-05-10
第一次就诊
左颈部-上纵隔见异常信号占位,上至左侧咽旁间隙,下达左上纵隔,呈蠕虫状改变,范围约 24.5 * 62.0 * 162.4 mm
图 1 患儿第一次就诊时颈部 MRI
左右滑动查看更多
2021-05-12
行左颈部肿瘤切除术
术中可见肿瘤位于左颈部颈阔肌深处,紧贴左侧颈动脉及颈静脉。手术顺利,肉眼完整切除肿瘤。
2021-10-21
第一次术后第一次复查,发现肿瘤复发
左颈部-上纵隔见异常信号占位,上至左侧咽旁间隙,下达左上纵隔,呈蠕虫状改变,范围约 22.8 * 61.5 * 142.2 mm。且发现颅内多发异常信号影,符合神经纤维瘤表现。
图 2 患儿第一次术后第一次复查颈部 MRI
左右滑动查看更多
2022-02-21
第一次术后第二次复查
左颈部-上纵隔异常信号影 23.2 * 54.5 * 141.2 mm,较前片增大,局部气道受压右移且稍窄
2022-08-08
第一次术后第三次复查
左颈部-上纵隔异常信号影 30.0 * 55.3 * 144.3 mm,较前片增大,局部气道受压右移且稍窄
2023-01-16
第一次术后第四次复查
左颈部-上纵隔异常信号影 34.2 * 67 * 156.2 mm,较前片增大,局部气道受压右移且稍窄
2023-02-07
考虑到肿物过大且压迫气道,行第二次纵隔病损切除术
术中可见肿瘤紧密包裹主动脉弓、右侧无名动脉、左侧颈内动脉及颈内静脉、左侧锁骨下动脉及分支,紧密包裹气管并累及左侧甲状腺,与迷走神经、膈神经及左侧心包黏连紧密,深部紧贴脊柱,部分突向椎间孔。手术顺利,肉眼完整切除颈部肿瘤、左上纵膈肿瘤及黏连的少许心包组织。
2023-05-08
第二次术后第一次复查,发现肿瘤再次复发
左颈部-上纵隔见异常信号占位,上至左侧咽旁间隙,下达左侧胸廓入口水平,呈蠕虫状改变,范围约 55.3 * 51.9 * 92.2 mm,较前片部分增大,部分病灶切除,局部气道受压右移且稍窄。
图 3 患儿第二次术后第一次复查颈部 MRI
左右滑动查看更多
2023-08-21
第二次术后第二次复查
左颈部-上纵隔异常信号影 53.2 * 52.3 * 92.7 mm,局部气道受压右移且稍窄
2024-02-05
第二次术后第三次复查
左颈部-上纵隔异常信号影 53.3 * 52.9 * 92.6 mm,局部气道受压右移且稍窄,较前片部分略进展
▲上下滑动查看▼
鉴于患者颈部左侧的丛状神经纤维瘤(PN)持续增大,并对气道造成压迫,且患者已经接受过两次手术,但未能实现彻底切除,专家建议采用靶向药物治疗作为下一步治疗方案。具体建议为:给予患者司美替尼 20 mg/Bid。这种治疗策略旨在控制肿瘤的生长,减轻症状,并提高患者的生活质量。
使用司美替尼 3 个月后复查,胸部 MRI 显示左颈部-上纵隔 PN 较前片范围稍缩小,查体显示体表咖啡斑变淡,脸部咖啡斑消失。
病例点评
一、PN 手术治疗及术后复发影响因素
有研究分析了 PN 的生长行为,发现 PN 的生长速率与患者初次 MRI 时的年龄呈负相关,大多数快速生长的 PN 出现在幼儿中,年龄较小的患者(特别是在 5 岁以下的儿童) PN 生长速率更快,而随着患者年龄的增长,肿瘤的生长速率逐渐下降[6]。研究还发现,肿瘤的生长速率与初始体积呈负相关[6]。
手术治疗是目前临床中最常用的 PN 治疗方式,但是由于瘤体起源于神经,同时血供丰富,手术风险高,手术难度大,需要进行系统性的综合评估,进行个性化的治疗策略选择[1]。推荐对产生临床症状的 PN 、具有恶变影像学证据的病灶及直径 > 6 cm 的肿块进行手术[1]。手术干预的时机尚存争议,有学者主张尽早手术,从而避免眼眶等部位并发症的发生及恶化,例如失明或脑膜脑膨出,此外,在病灶体积较小时进行干预完全切除的机会更大,复发率也会降低[1]。另一些学者建议青春期后,待病变稳定后再进行干预,也有学者主张干预时间应尽量推迟,因为手术越早,需进行重复手术的次数越多[1]。
手术方式根据切除瘤体的比例可分为全切除/近全切除(> 80%/90%),次全切除(50%~80%/90%),以及部份切除(< 50%)[1]。如果可行,推荐全切除/近全切除[1]。对于体积巨大或浸润性肿瘤,考虑到其良性性质,手术策略为切除肿瘤以缓解症状,同时保留神经功能[1]。
一项研究分析了 52 例 PN 患者术后肿瘤生长行为,结果显示,在中位 2.9 年的随访时间内,肿瘤复发率较高,39 位患者出现术后复发,9 位的患者出现显著肿瘤进展(每年变化超过 20%)[4]。
PN 术后复发较为常见,各项回顾性研究报道复发概率在 25%~66% 不等,复发或再次进展与多种因素相关,包括切除范围、患者年龄、肿瘤位置和生长类型(表 1)[1]。手术切除范围越小、患者手术年龄越小,术后复发进展的风险越高[1]。不同部位的 PN 表现出不同的术后复发率,头部、颈部、面部肿瘤进展率最高,躯干部次之,四肢部位复发率最低[1]。在不同的生长类型中,移位型较浅表型或侵袭型出现更多复发案例[1]。此外,研究显示 PN 的术后进展类似于自病程,提示术后生长可能与是否手术无关[1]。
表 1 丛状神经瘤患者术后复发风险评估
一项研究对费城儿童医院 1974~1994 年间接受手术的 121 名 PN 患者术后进展情况进行回顾性分析,结果显示总体无进展生存率为 54% ,10 岁及以下儿童中有 60.2% 在首次手术后经历了肿瘤进展,而 10 岁以上的儿童中这一比例为 31.2%[7]。研究还发现,切除范围越大,肿瘤进展风险越低,进展时间越长。完全切除的进展率为 20% ,近全切除(大于 90% 切除)为 39.5% ,次全切除(大于 50% 但小于 90% 切除)为 44.6% ,活检切除(小于 50% 切除)为 67.7%[7]。不同切除范围的肿瘤进展中位时间也不同,活检切除的肿瘤进展中位时间小于 2 年,次全切除的肿瘤为 5 年,而近全切除的肿瘤则大于 10 年[7]。
在上述病例中,患者虽然两次手术均肉眼完整切除肿瘤,但仍在几个月内复发。可能的原因包括:手术肉眼可见的完整切除,不一定真正做到了完整切除;患者首次手术时年龄仅 5 岁,且肿瘤位于头颈部,为术后复发高危人群。
二、小分子丝裂原细胞外激酶(MEK)抑制剂有效抑制 PN 术后再生长
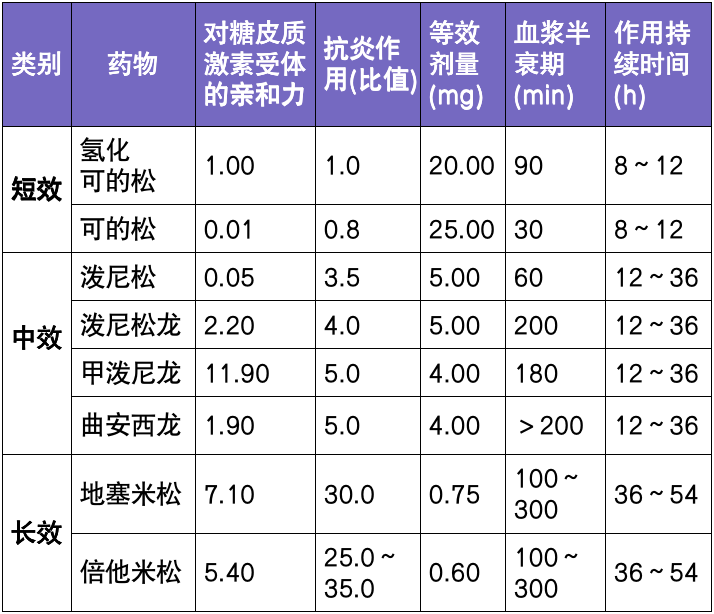
上述病例中,患者两次手术后出现复发,使用司美替尼 3 个月后肿瘤缩小,体表咖啡斑变淡,脸部咖啡斑消失。司美替尼是一种 MEK 抑制剂,在 1 型神经纤维瘤病多学科诊治指南(2023 版)中被列为 NF1-PN 患者最主要的靶向治疗药物[1]。2022 年在 Neuro Oncol 上发表的 1 型神经纤维瘤病(NF1)MEK 抑制剂治疗共识中,重点推荐了司美替尼治疗 NF1-PN 儿童患者[8]。2023 年 4 月,司美替尼在我国正式获批用于 3 岁及以上伴有症状、无法手术的 PN 的 NF1 儿童患者。
科罗拉多儿童医院进行的一项关于 NF1-PN 患者术后不同处理方法对预后影响的研究[9],对接受次全切除手术(STR)的 43 例 NF1-PN 患者共 49 个肿瘤病灶进行了回顾性分析。按 PN 数目计,14 个病灶仅手术,10 个病灶术后哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂辅助治疗,25 个病灶术后 MEK1/2 抑制剂辅助治疗。研究发现,与单独接受 STR 或术后 mTOR 抑制剂辅助治疗相比,术后 MEK1/2 抑制剂辅助治疗在抑制复发方面效果显著,将需要进一步治疗的患者比例由 78.6% 左右降低到了 24%,且耐受性良好(表 2)。
表 2 接受次全切除术的 PN 患者接受不同术后治疗后需进一步治疗的比例
三、MEK 抑制剂可长期延缓无法手术 PN 患者疾病进展
除了可抑制术后复发,司美替尼在无法手术患者中也体现出了良好疗效[10]。SPRINT 研究是一项针对 NF1-PN 无法手术的 2~18 岁患者(实际入组患者年龄范围 3.5~17.4 岁,中位数为 10.2 岁)司美替尼治疗的 Ⅰ/Ⅱ 期研究(无法手术是指由于 PN 包裹或接近重要结构、具有侵入性或血管高度密集,而无法在没有实质性发病风险的情况下经手术完全切除)[10]。5 年的长期随访研究显示,SPRINT Ⅱ 期研究使用司美替尼治疗的 NF1-PN 患者中,PD 患者中位进展时间为 36 个周期(约 2.7 年),整个Ⅱ期队列的中位 PFS 尚未达到。而先前发布的与年龄相匹配的自然史患者群体的 mPFS 仅为 1.3 年(图 4),这一数据表明司美替尼可长期延缓无法手术 PN 患者疾病进展[11]。
图 4 SPRINT 长期随访研究无进展生存期数据
四、PN 药物治疗整体情况
除司美替尼外,新的靶向药物也在不断涌现,例如其他 MEK 抑制剂、mTOR 抑制剂、酪氨酸激酶抑制剂(TKI)等,为 PN 患者提供了新的治疗方式[1]。
2023 年 ASCO会议发布的 MEK1/2 抑制剂复迈替尼治疗儿童 NF1-PN 的 Ⅱ 期临床研究数据显示,43 例受试者的研究者和盲态独立审查委员会评估的 ORR 分别为 48.8% 和 30.2%[12]。MEK 抑制剂曲美替尼的一项 Ⅰ/Ⅱa 期临床研究显示,26 名 NF1-PN 患儿中有 12 名(46%)接受司美替尼治疗后达到 PR[8]。Mirdametinib 在 16 岁及以上 NF1-PN 患者中的Ⅱb 期临床研究结果显示,42% 的患者(8/19)达到部分缓解[13]。
酪氨酸激酶抑制剂 Cabozantinib 的一项 Ⅱ 期、开放标签、非随机 Simon 两阶段研究纳入大于 16 岁不能手术的 NF1-PN 患者,经过 12 个周期的治疗后,19 名可评估受试者中有 8 名(42%)达到部分缓解(PR,定义为通过 MRI 评估靶病灶体积减少 20%),治疗期间无患者出现疾病进展,9 例患者因不良反应需要减少剂量或停止治疗[14]。一些潜在的疗法,包括基因治疗、免疫疗法等,目前仍处于研究阶段,可能在不久的将来用于 PN 的治疗[1]。
小结
NF1-PN 在儿童时期生长迅速,手术治疗仍是目前 NF1-PN 的主要治疗手段,但存在局限性,易出现术后复发。术后复发率主要与切除范围、患者年龄、肿瘤位置和生长类型等有关。
由于手术治疗操作难度大、有多种并发症,术后易复发,对无法在没有实质性发病风险的情况下经手术完全切除的患者,在进行手术考量时应谨慎,并考虑药物治疗。目前关于 NF1 药物治疗的研究主要集中在 MEK 抑制剂上,期待靶向治疗为中国 NF1-PN 患儿带来更多临床获益。
专家介绍
顾松 教授
主任医师,外科学博士,硕士研究生导师
上海交通大学医学院附属上海儿童医学中心普外科
中国儿童血管瘤及血管畸形联盟常委
中国抗癌协会儿童肿瘤专业委员会委员
中华医学会小儿外科分会儿童肿瘤学组委员
中国研究型医院学会儿童肿瘤专业委员会委员
中国癌症预防与筛查专业委员会委员
上海市抗癌协会青年理事会常务理事
「中国癌症杂志」第五届编委会,常务青年编委
「Frontiers in Oncology」、「Future Science OA」特约审稿人
参与制定 2022CACA 肝母细胞瘤、神经母细胞瘤指南
特别声明:本材料由阿斯利康支持,仅供医疗卫生专业人士参考。此为专家个人经验分享,未经作者授权不得使用本材料。不得用于推广目的。
审批编号:CN-142653 过期日期:2025-9-5
内容策划:韩雪珂
项目审核:张晓燕
题图来源:图虫创意
参考文献
[1] 朱以诚.Ⅰ型神经纤维瘤病多学科诊治指南(2023版)[J].罕见病研究,2023,2(02):210-230.
[2] Blakeley JO, Plotkin SR. Therapeutic advances for the tumors associated with neurofibromatosis type 1, type 2, and schwannomatosis. Neuro Oncol. 2016 May;18(5):624-38.
[3] Gross A M , Dombi E , Widemann B C .Diagnosis and Management of Benign Nerve Sheath Tumors in NF1: Evolution from Plexiform to Atypical Neurofibroma and Novel Treatment Approaches[J]. 2020.
[4] Nguyen R, Ibrahim C, Friedrich RE, Westphal M, Schuhmann M, Mautner VF. Growth behavior of plexiform neurofibromas after surgery. Genet Med. 2013 Sep;15(9):691-7.
[5] 儿童及青少年神经纤维瘤病诊疗规范(2021年版)
[6] Akshintala S, Baldwin A, Liewehr DJ, Goodwin A, Blakeley JO, Gross AM, Steinberg SM, Dombi E, Widemann BC. Longitudinal evaluation of peripheral nerve sheath tumors in neurofibromatosis type 1: growth analysis of plexiform neurofibromas and distinct nodular lesions. Neuro Oncol. 2020 Sep 29;22(9):1368-1378.
[7] Needle MN, Cnaan A, Dattilo J, Chatten J, Phillips PC, Shochat S, Sutton LN, Vaughan SN, Zackai EH, Zhao H, Molloy PT. Prognostic signs in the surgical management of plexiform neurofibroma: the Children’s Hospital of Philadelphia experience, 1974-1994. J Pediatr. 1997 Nov;131(5):678-82.
[8] de Blank PMK,et al. MEK inhibitors for neurofibromatosis type 1 manifestations: Clinical evidence and consensus. Neuro Oncol. 2022 Nov 2;24(11):1845-1856.
[9]Adiuvant MEK inhibition to prevent rebound growth following partial resection of plexiform neurofibromas.
[10]Gross AM, Wolters PL, Dombi E. Selumetinib in Children with Inoperable Plexiform Neurofibromas. N Engl J Med. 2020 Apr 9;382(15):1430-1442.
[11] Gross AM, et al. Long-term safety and efficacy of selumetinib in children with neurofibromatosis type 1 on a phase 1/2 trial for inoperable plexiform neurofibromas. Neuro Oncol. 2023 Oct 3;25(10):1883-1894.
[12] JinHu Wang et al., Efficacy and safety of FCN-159, a MEK1/2 inhibitor in pediatric participants with neurofibromatosis type 1: Results from a phase 2 trial. JCO 42, 3096-3096(2024).
[12] Wang Z, Zhang X, Li C. Safety, pharmacokinetics and efficacy of selumetinib in Chinese adult and paediatric patients with neurofibromatosis type 1 and inoperable plexiform neurofibromas: The primary analysis of a phase 1 open-label study. Clin Transl Med. 2024 Mar;14(3):e1589.
[13] Weiss BD, et al. NF106: A Neurofibromatosis Clinical Trials Consortium Phase II Trial of the MEK Inhibitor Mirdametinib (PD-0325901) in Adolescents and Adults With NF1-Related Plexiform Neurofibromas. J Clin Oncol. 2021 Mar 1;39(7):797-806.
[14] Fisher MJ, et al. Cabozantinib for neurofibromatosis type 1-related plexiform neurofibromas: a phase 2 trial. Nat Med. 2021 Jan;27(1):165-173.




暂无评论内容