发现颈动脉斑块都需要吃阿司匹林、他汀吗?斑块会缩小或消失吗?
原创 作者:方琪、周赟 公号:丁香园神经时间 发布时间:2023-03-25 20:00
原文地址:发现颈动脉斑块都需要吃阿司匹林、他汀吗?斑块会缩小或消失吗?
1 什么是颈动脉斑块?
如何形成的?
《Lancet》子刊上的一项研究对全球 21 个国家和地区人群的颈动脉粥样硬化患病率、患病人数和危险因素进行了评估,显示 2020 年全球有近 20 亿人颈动脉粥样硬化。我国 40 岁以上的人群中,颈动脉斑块的检出率超过 40%。
颈动脉粥样硬化、颈动脉斑块的破裂和脱落、颈动脉狭窄和闭塞均可导致缺血性脑血管事件的发生。通过各种手段早期发现并对颈动脉粥样硬化斑块进行评估,可有效降低心脑血管疾病风险。
![[]](https://img.medblog.cn/medblog/neurotime/f2eefb78-1721-4115-af9b-b523e765c30b.png)
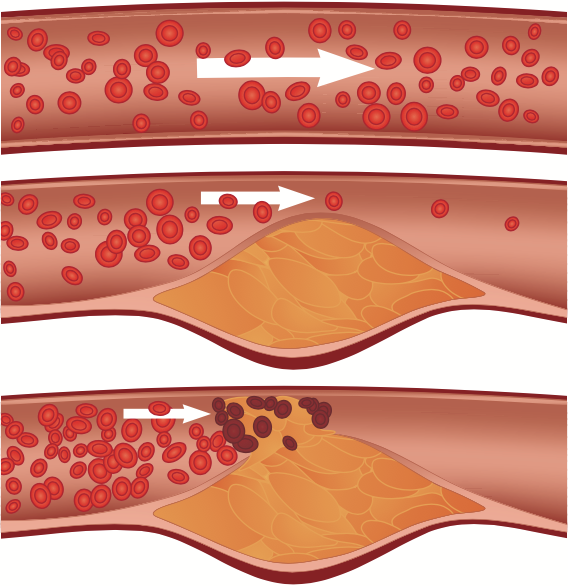
图 1. 正常内膜 → 内膜增厚 → 斑块形成
图源:站酷海洛
颈动脉斑块是一种动脉内膜下局灶性病变结构,定义为局部浸润动脉管腔 0.5 mm 以上,或局灶性内膜内侧增厚大于周围区域的 50%,或颈动脉内-中膜层(IMT)大于 1.5 mm[1]。
因颈动脉内-中膜层(IMT)在颈动脉粥样硬化的过程中最易被累及,临床上常通过测量 IMT 厚度作为诊断颈动脉硬化的主要标准:IMT < 1.0 mm 为正常;IMT 在 1.0~1.5 mm 为内-中膜增厚/动脉粥样硬化;IMT > 1.5 mm 为斑块形成[2]。
颈动脉斑块的形成:
颈动脉斑块通常是动脉粥样硬化的特征性表现,动脉粥样硬化的发生有多种学说,目前主流学说是「内皮损伤-炎症反应」学说。
动脉硬化早期,在各类危险因素包括内皮损伤、脂质代谢异常、血流动力学改变的刺激下,大量低密度脂蛋白(LDL)被氧化为氧化低密度脂蛋白(oxLDL),单核细胞分化为巨噬细胞不断摄取 oxLDL 并转化为泡沫细胞。
大量泡沫细胞在动脉内膜聚集形成脂纹,随着病程进展,脂纹逐渐增大形成斑块,并在斑块表面出现胶原纤维的沉积,同时平滑肌细胞分泌大量的细胞外基质,从而形成厚薄不均的纤维帽。纤维帽下的泡沫细胞、胆固醇、细胞外脂质等成分,构成了颈动脉粥样硬化斑块脂质核。
在动脉粥样硬化晚期,大量巨噬细胞等炎性细胞因子浸润血管壁,分泌基质金属蛋白酶(matrix metalloproteinases,MMPs),降解斑块细胞外基质中的胶原纤维,导致斑块破裂、出血、血栓形成,导致心脑血管事件的发生。
(上下滑动可查看 ▼▲)
2 颈动脉斑块的危险因素
颈动脉斑块的危险因素分为可控制和不可控制两类。后者主要指的是年龄、性别、种族、遗传因素等;而传统的可控制危险因素包括高血压、糖尿病、冠心病、高血脂、稳定性心绞痛和慢性肾病。
还有一些危险因素包括剪应力、颈动脉粥样硬化斑块形态学危险因素、颈动脉粥样硬化斑块和血液中的生化危险因素、感染危险因素(如肺炎衣原体)[4]。
3 颈动脉斑块的分类
颈动脉斑块主要分为易损斑块和稳定斑块。
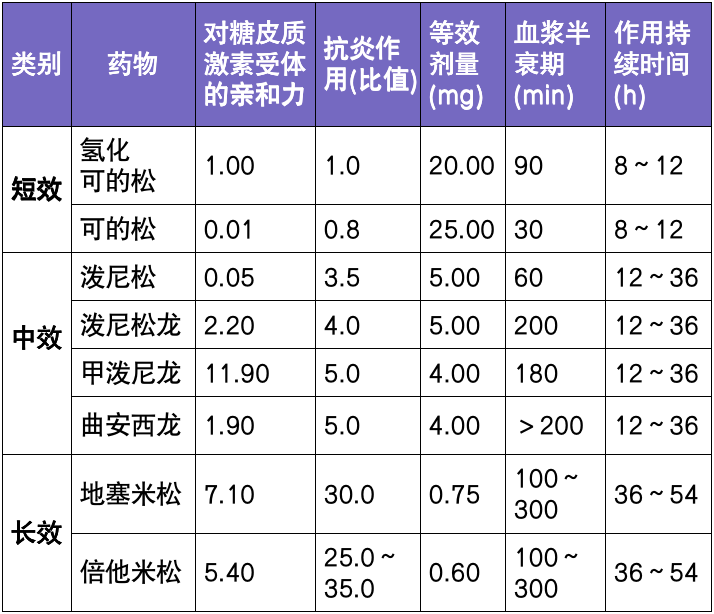
2000 年,美国心脏病协会(AHA)更新斑块分型为 I~VIII 型,其中富脂质核(IV、V 型)和斑块内出血、纤维帽破裂和(或)突入管腔的钙化结节(VI 型)的复杂斑块为易损斑块[5]。
易损斑块,指所有形成血栓倾向较大及容易快速进展的斑块,其病理特点主要包括薄和(或)破裂的纤维帽、大脂质坏死核、斑块表面溃疡及血栓形成、斑块内出血、炎症细胞浸润、 新生血管形成等;与此相反,稳定的颈动脉斑块的特征是厚的纤维帽,不含丰富的脂质核。
表 1. 斑块的分类
![[]](https://img.medblog.cn/medblog/neurotime/3ed8d59c-5443-4b31-9292-e15e6cf0315e.png)
4 颈动脉斑块都需要治疗吗?
根据《中国头颈部动脉粥样硬化诊治共识 2017》,并非所有颈动脉斑块都需要治疗,通常要考虑整体心血管风险再决定是否应用降脂等药物治疗,但均需要进行生活方式的调整,尽量减少不良生活习惯,控制脑血管病危险因素,预防心脑血管事件的发生。具体如下:
1)对于颈动脉斑块患者,无缺血性脑卒中症状,建议控制高血压、糖尿病、血脂异常和吸烟、饮酒等相关危险因素。
2)对于颈动脉不稳定斑块或斑块狭窄 50% 以上者,无缺血性脑卒中症状,无论血脂是否异常,建议使用他汀类药物治疗,使 LDL-C 控制在 1.8 mmol/L以下。
3)对于颈动脉斑块伴狭窄 50% 以下的患者,无缺血性脑卒中症状,血脂在正常范围内,可根据斑块稳定性和用药风险效益比个体化考虑是否选用他汀类药物治疗。
4)对于颈动脉斑块患者,如果近期发生缺血性脑卒中,建议使用他汀类药物治疗,参照《中国缺血性脑卒中和短暂性脑缺血发作二级预防指南 2014》。
5 颈动脉斑块如何治疗?
治疗方式主要包括调整生活方式、控制危险因素、适当的药物治疗和血运重建术[6]。
1)生活方式干预**
有氧运动和抗阻运动相结合,每周至少 150 分钟中等强度运动,或每周至少 75 分钟高强度有氧运动,或等量两种强度活动的组合;
健康饮食,结构多样化,限制游离糖摄入,包括含糖饮料;减少盐分摄入;保持健康体重;戒烟限酒;保持心理健康。
2)控制危险因素**
若患者同时存在高血压、糖尿病等易导致动脉斑块形成的疾病,更应该积极控制血压、稳定血糖,管控卒中危险因素。
• 一般高血压患者血压降至 140/90 mmHg 以下;能耐受者和部分高危患者可进一步降至 130/80 mmHg 以下;80 岁以上患者,血压应控制在 150/80 mmHg 以下。
• 大多数 1 型或 2 型糖尿病患者的 HbA1c 目标为 < 7.0%;老年人和体弱者的血糖标准应该适当放宽。
• 对于动脉粥样硬化性心血管疾病(ASCVD)预防,主要包括主要包括缺血性心脏病和缺血性脑卒中,控制血脂水平非常重要,根据人群个体化为危险分层,目标值不同。
3)药物治疗**
他汀类药物:
他汀是治疗颈动脉斑块的基石,主要用于专门减少胆固醇合成,同时可以有效降低炎性生物标志物如 CRP 的水平,而不依赖于降低胆固醇水平。
他汀类药物的抗炎作用可能部分是通过其降脂作用实现的,但有大量证据表明他汀类药物对参与动脉粥样硬化斑块发展和破裂的细胞具有直接的抗炎作用。他汀类药物可降低巨噬细胞的生长及其 MMP 活性,从而稳定动脉粥样硬化易损斑块。
他汀类药物是 3-羟基-3-甲基戊二酰辅酶 A(HMG-CoA)还原酶抑制剂,通过竞争性抑制内源性胆固醇合成限速酶 HMG-CoA 还原酶,使细胞内胆固醇合成减少,减少斑块内的脂质核、增厚纤维帽达到稳定斑块的作用。
临床常用的降脂药物主要还包括胆固醇吸收抑制剂及 PCSK9 抑制剂等。其中 PCSK9 抑制剂具有强大的降胆固醇作用,可降低 LDL-C 50%~70%,为近年来研究的热点。
抗血小板药物:
阿司匹林具有抗炎、抗氧化、保护血管内皮细胞、抑制平滑肌及细胞生长、稳定斑块、抗血小板聚集作用。具体根据患者个体化情况按需应用。
① 若患者存在明显的颈动脉狭窄(狭窄 ≥ 50%),一般均应服用阿司匹林(每日 75~150 mg);
② 若患者只是存在一处或多处斑块,但未导致管腔狭窄,或虽有狭窄但狭窄程度 < 50%,则需要结合患者所存在的其他心血管危险因素确定是否需要服用阿司匹林进行一级预防。
此类患者若具有以下 ≥ 3 种危险因素,则建议用阿司匹林(每日 75~150 mg):
• 男性 ≥ 50 岁或女性绝经期后;
• 得到初步控制的高血压(高血压患者经治疗后血压 < 150/90 mmHg);
• 糖尿病;
• 高胆固醇血症;
• 肥胖(体质量指数 ≥ 28);
• 早发心血管病家族史(父母一方或双方男性 < 55 岁,女性 < 65 岁发病);
• 吸烟。
此外,高血压合并慢性肾病者也是应用阿司匹林的适应证。
4)血运重建术
颈内动脉内膜剥脱术(CEA)和颈动脉球囊扩张和支架血管成形术(CSA)能降低症状性(狭窄 > 50%)和非症状性(狭窄 > 70%)颈动脉狭窄患者的卒中风险。
>> 美国心脏协会(AHA)/美国卒中协会(ASA)在缺血性卒中和短暂脑缺血发作指南中指出:
对于临床表现为一过性脑缺血、黑矇或脑梗死等其他脑缺血症状的患者,无创性成像证实颈动脉狭窄超过 70%,或血管造影发现狭窄超过 50%,且预期围手术期卒中或死亡率应小于 6%,以及颈动脉狭窄程度大于 70% 的无症状患者,且预期围手术期卒中或死亡率应小于 3% 均应给予积极的血运重建治疗。
对于选择 CEA 还是 CAS 进行颈动脉狭窄病变的治疗,临床医生不仅应该考虑到对于两种治疗手段自身操作的熟练程度,而且应该依据两种治疗手段各自对应的适应证。
6 颈动脉斑块可以缩小或消失吗?
随着医学的进步以及对疾病认识的深入,人们发现通过生活方式的改变,调整饮食结构和生活方式,接受恰当的药物治疗,部分颈动脉斑块是可以逆转,缩小甚至消失的[7]。
通过比较高强度他汀和低强度他汀药物治疗后斑块体积大小的变化,发现高强度他汀可以延缓动脉粥样硬化进展,甚至逆转斑块[8]。
FOURIER 和 ODYSSEY OUTCOMES 研究显示,在使用大剂量他汀的基础上,加用 PCSK9 抑制剂能进一步降低 LDL-C 水平达 60% 左右,且能更明显的减少动脉粥样硬化斑块总体积,进一步减少主要心血管不良事件风险。
7 如何预防颈动脉斑块?
颈动脉斑块的形成是在诸多危险因素协同作用下导致的。
随着年龄的增长,机体逐渐出现自我更新能力的降低及功能的紊乱,血管内皮细胞的更新及修复能力降低,同时吸烟、高血压、糖尿病、高脂血症、高同型半胱氨酸血症等其他危险因素协同损伤血管内皮功能,导致了动脉粥样硬化斑块的形成。
若要做到预防颈动脉斑块,需避免形成颈动脉斑块的危险因素,坚持健康的生活方式,合理膳食、戒烟限酒、适量运动、心理健康;控制血压、血糖、血脂、同型半胱氨酸水平;定期体检。
没看够?
一定要星标关注呦 🌟
每天 20:00 点
第一时间接收神经时间的优质专业内容
策划|时间胶囊
投稿|zhangjing3@dxy.cn
题图|站酷海洛
![[]](https://img.medblog.cn/medblog/neurotime/43d27237-e229-49eb-bd96-27d688cc8249.png)
参考文献:
[1] Touboul PJ, Hennerici MG, et al. Mannheim carotid intima-media thickness and plaque consensus (2004-2006-2011). An update on behalf of the advisory board of the 3rd, 4th and 5th watching the risk symposia, at the 13th, 15th and 20th European Stroke Conferences, Mannheim, Germany, 2004, Brussels, Belgium, 2006, and Hamburg, Germany, 2011. Cerebrovasc Dis. 2012;34(4):290-6.
[2] Johri AM, Nambi V, et al. Recommendations for the Assessment of Carotid Arterial Plaque by Ultrasound for the Characterization of Atherosclerosis and Evaluation of Cardiovascular Risk: From the American Society of Echocardiography. J Am Soc Echocardiogr. 2020 Aug;33(8):917-933.
[3] Zhu Y, Xian X, et al. Research Progress on the Relationship between Atherosclerosis and Inflammation. Biomolecules. 2018 Aug 23;8(3):80.
[4] Xiong XD, Xiong WD, et al. Research Progress on the Risk Factors and Outcomes of Human Carotid Atherosclerotic Plaques. Chin Med J (Engl). 2017 Mar 20;130(6):722-729.
[5] Virmani R, Kolodgie FD, et al. Lessons from sudden coronary death: a comprehensive morphological classification scheme for atherosclerotic lesions. Arterioscler Thromb Vasc Biol. 2000 May;20(5):1262-75.
[6] Visseren FLJ, Mach F, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-3337.
[7] Dawson LP, Lum M, et al. Coronary Atherosclerotic Plaque Regression: JACC State-of-the-Art Review. J Am Coll Cardiol. 2022 Jan 4;79(1):66-82.
[8] Puri R, Nissen SE, et al. Factors underlying regression of coronary atheroma with potent statin therapy. Eur Heart J. 2013 Jun;34(24):1818-25.




暂无评论内容